Гемоглобин (Hb) — это железосодержащий металлопротеин, в большом количестве содержащийся в красных кровяных клетках практически всех позвоночных. Его часто называют «молекулой, поддерживающей жизнь», за его незаменимую роль в дыхании. Этот сложный белок отвечает за важнейшую задачу транспортировки кислорода из легких во все ткани организма и облегчения возврата углекислого газа для выведения. Понимание его функций, сложных механизмов, управляющих его поведением, и первостепенной важности его клинического измерения открывает окно в понимание здоровья человека и болезней.
Функция и механизм: шедевр молекулярной инженерии.
Основная функция гемоглобина — транспортировка газов. Однако он выполняет эту функцию не как простая пассивная губка. Его эффективность обусловлена сложной структурой и динамическими механизмами регуляции.
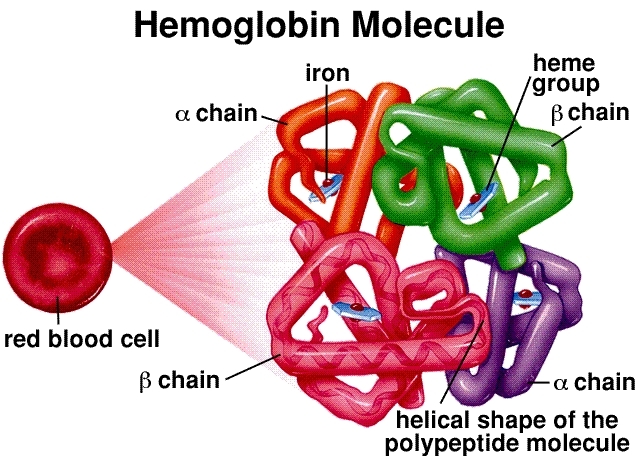
Молекулярная структура: Гемоглобин представляет собой тетрамер, состоящий из четырех цепей глобинового белка (две альфа- и две бета-цепи у взрослых). Каждая цепь связана с гемовой группой, сложной кольцевой структурой с центральным атомом железа (Fe²⁺). Этот атом железа является фактическим местом связывания молекулы кислорода (O₂). Таким образом, одна молекула гемоглобина может переносить максимум четыре молекулы кислорода.
Кооперативное связывание и сигмоидальная кривая: это краеугольный камень эффективности гемоглобина. Когда первая молекула кислорода связывается с гемовой группой в легких (где концентрация кислорода высока), она вызывает конформационное изменение всей структуры гемоглобина. Это изменение облегчает связывание двух последующих молекул кислорода. Последняя, четвертая молекула кислорода связывается с наибольшей легкостью. Это «кооперативное» взаимодействие приводит к характерной сигмоидальной (S-образной) кривой диссоциации кислорода. Эта S-образная форма имеет решающее значение — она означает, что в богатой кислородом среде легких гемоглобин быстро насыщается, но в бедных кислородом тканях он может высвободить большое количество кислорода при небольшом падении давления.
Аллостерическая регуляция: Сродство гемоглобина к кислороду не является фиксированным; оно тонко регулируется метаболическими потребностями тканей. Это достигается с помощью аллостерических эффекторов:
Эффект Бора: В активных тканях высокая метаболическая активность приводит к образованию углекислого газа (CO₂) и кислоты (ионов H⁺). Гемоглобин реагирует на эту химическую среду, уменьшая свое сродство к кислороду, что вызывает более интенсивное высвобождение O₂ именно там, где он больше всего необходим.
2,3-бисфосфоглицерат (2,3-БФГ): это соединение, вырабатываемое в эритроцитах, связывается с гемоглобином и стабилизирует его деоксигенированное состояние, дополнительно способствуя высвобождению кислорода. Уровень 2,3-БФГ повышается в условиях хронической гипоксии, например, на больших высотах, для усиления доставки кислорода.
Транспорт углекислого газа: Гемоглобин также играет жизненно важную роль в транспорте CO₂. Небольшая, но значительная часть CO₂ связывается непосредственно с глобиновыми цепями, образуя карбаминогемоглобин. Кроме того, буферизуя ионы H⁺, гемоглобин облегчает транспорт большей части CO₂ в виде бикарбоната (HCO₃⁻) в плазме.
Критическая важность анализа уровня гемоглобина
Учитывая центральную роль гемоглобина, измерение его концентрации и оценка его качества являются основополагающими принципами современной медицины. Анализ на гемоглобин, часто входящий в состав общего анализа крови (ОАК), является одним из наиболее часто назначаемых клинических исследований. Его важность невозможно переоценить по следующим причинам:
Мониторинг прогрессирования заболевания и лечение:
Для пациентов с диагнозом анемия серийные измерения уровня гемоглобина необходимы для мониторинга эффективности лечения, например, приема препаратов железа, а также для отслеживания прогрессирования сопутствующих хронических заболеваний, таких как почечная недостаточность или рак.
Выявление гемоглобинопатий:
Специализированные анализы гемоглобина, такие как электрофорез гемоглобина, используются для диагностики наследственных генетических заболеваний, влияющих на структуру или продукцию гемоглобина. Наиболее распространенными примерами являются серповидноклеточная анемия (вызванная дефектным вариантом HbS) и талассемия. Ранняя диагностика имеет решающее значение для лечения и генетического консультирования.
Оценка полицитемии:
Аномально высокий уровень гемоглобина может указывать на полицитемию — состояние, при котором организм вырабатывает слишком много красных кровяных клеток. Это может быть первичным заболеванием костного мозга или вторичной реакцией на хроническую гипоксию (например, при заболеваниях легких или на больших высотах), и оно несет в себе риск тромбоза.
Скрининг и общая оценка состояния здоровья: анализ уровня гемоглобина является рутинной частью дородового наблюдения, предоперационных осмотров и общих профилактических обследований. Он служит общим показателем состояния здоровья и питания.
Контроль диабета: Хотя анализ на гликированный гемоглобин (HbA1c) не является стандартным анализом гемоглобина, он измеряет количество глюкозы, присоединившейся к гемоглобину. Он отражает средний уровень сахара в крови за последние 2-3 месяца и является золотым стандартом для долгосрочного контроля уровня глюкозы у пациентов с диабетом.
Заключение
Гемоглобин — это гораздо больше, чем просто переносчик кислорода. Это молекулярная машина с изысканной конструкцией, использующая кооперативное связывание и аллостерическую регуляцию для оптимизации доставки кислорода в ответ на динамические потребности организма. Следовательно, клиническое измерение гемоглобина — это не просто цифра в лабораторном отчете; это мощный, неинвазивный диагностический и мониторинговый инструмент. Он предоставляет незаменимую информацию о гематологическом и общем состоянии здоровья человека, позволяя диагностировать заболевания, изменяющие жизнь, контролировать хронические болезни и сохранять общественное здоровье. Понимание как его биологического потенциала, так и клинической значимости подчеркивает, почему этот скромный белок остается краеугольным камнем физиологической и медицинской науки.
Дата публикации: 17 октября 2025 г.